"Wir bekommen jeden Computer in die Knie"
“Wir bekommen jeden Computer in die Knie”
Markus Oppel ist Senior Scientist an der Universität Wien und erzählt, wie die Theoretische Chemie jeden Supercomputer killen kann, warum es Quantencomputer überhaupt gibt und weshalb ein einziges Schwefel-Atom das Hautkrebsrisiko für Transplantationspatient:innen erhöht. Ein Gespräch über Zufälle, Rechenpower und Teamgeist.
Bettina Benesch
Herr Oppel, Sie arbeiten als Senior Scientist für Theoretische Chemie der Universität Wien. Gab es einen Schlüsselmoment in Ihrem Leben, an dem Sie gesagt haben: „Theoretische Chemie forever!“?
Markus Oppel: Ich hatte im dritten Semester meines Chemiestudiums einen Schlüsselmoment, als es mit Physikalischer Chemie losging, die mit der Theoretischen Chemie verwandt ist. Die ganze Quantenmechanik, die Schrödingergleichung, das hat mich fasziniert und mir war klar: In diesem Feld bleibe ich.
Heute arbeiten Sie auch im High-Performance- und Quantum Computing. Wie kam es dazu?
Markus Oppel: Ich habe schon als Jugendlicher selbst programmiert. Mit 18 war mir allerdings nicht klar, dass man so etwas auch studieren könnte.

Bis ich im Chemiestudium die ersten Programmierkurse belegt und erkannt habe: Ich kann meine Begeisterung für Computer mit der Chemie kombinieren. Heute bin ich unter anderem für die Administration unseres eigenen Clusters zuständig, begleite unsere Wissenschaftler:innen bei ihren Projekten und berate sie, auf welchem Supercomputer sie ihre Rechnungen am besten machen können.
Supercomputer oder Quantencomputer sind seit jeher mit der Chemie verbunden, oder?
Markus Oppel: Genau. 1926 hat Schrödinger seine berühmten Paper mit der Gleichung veröffentlicht, die die Quantenmechanik mathematisch exakt beschreibt, und relativ schnell danach gab es auch schon Konzepte, wie man das auf chemische Probleme anwenden kann.
Das waren damals natürlich nur Bleistift- und Papiermodelle, man konnte das nicht wirklich in der Praxis auf einem Rechner einsetzen. Aber in den 1950er-Jahren kamen die ersten Computer auf, und die Quantenchemiker waren unter den ersten, die darauf gerechnet haben, weil du nicht mit Papier und Bleistift tausende von Integralen lösen kannst, um die Struktur eines Moleküls zu berechnen.
“
So wurde die Theoretische Chemie sozusagen das Versuchskaninchen des Computings im Allgemeinen und des High-Performance Computings im Speziellen, denn wir können jede Rechnung systematisch verbessern und aufwändiger machen, was natürlich immer mehr Rechenleistung braucht.
„
Und so wurde die Theoretische Chemie sozusagen das Versuchskaninchen des Computings im Allgemeinen und des High-Performance Computings im Speziellen, denn wir können jede Rechnung systematisch verbessern und aufwändiger machen, was natürlich immer mehr Rechenleistung braucht. Man könnte sagen: Wenn wir wollen, bekommen wir jeden Computer in die Knie.
Bleiben wir kurz beim Thema Quantencomputing. Ich habe das Gefühl, es ist eines der heißen Themen, aber wirklich durchschaut ist das Thema noch nicht. Wie sehen Sie das?
Markus Oppel: Stimmt, jeder hat eine andere Meinung dazu.
Können Sie Quantencomputing dennoch so erklären, sodass es ein Laie da draußen versteht?
Markus Oppel: Es gibt diesen berühmten Spruch von Richard Feynman, der 1965 gemeinsam mit zwei anderen Forschern den Nobelpreis für Physik bekommen hat. Er meinte sinngemäß – vermutlich salopp bei einem Bier oder Wein: Wenn wir quantenmechanische Systeme beschreiben und mit ihnen rechnen, verwenden wir klassische Rechenmethoden auf klassischen Computern. Stattdessen sollten wir quantenmechanikbasierte Rechenmethoden verwenden, um Quantensysteme zu simulieren.
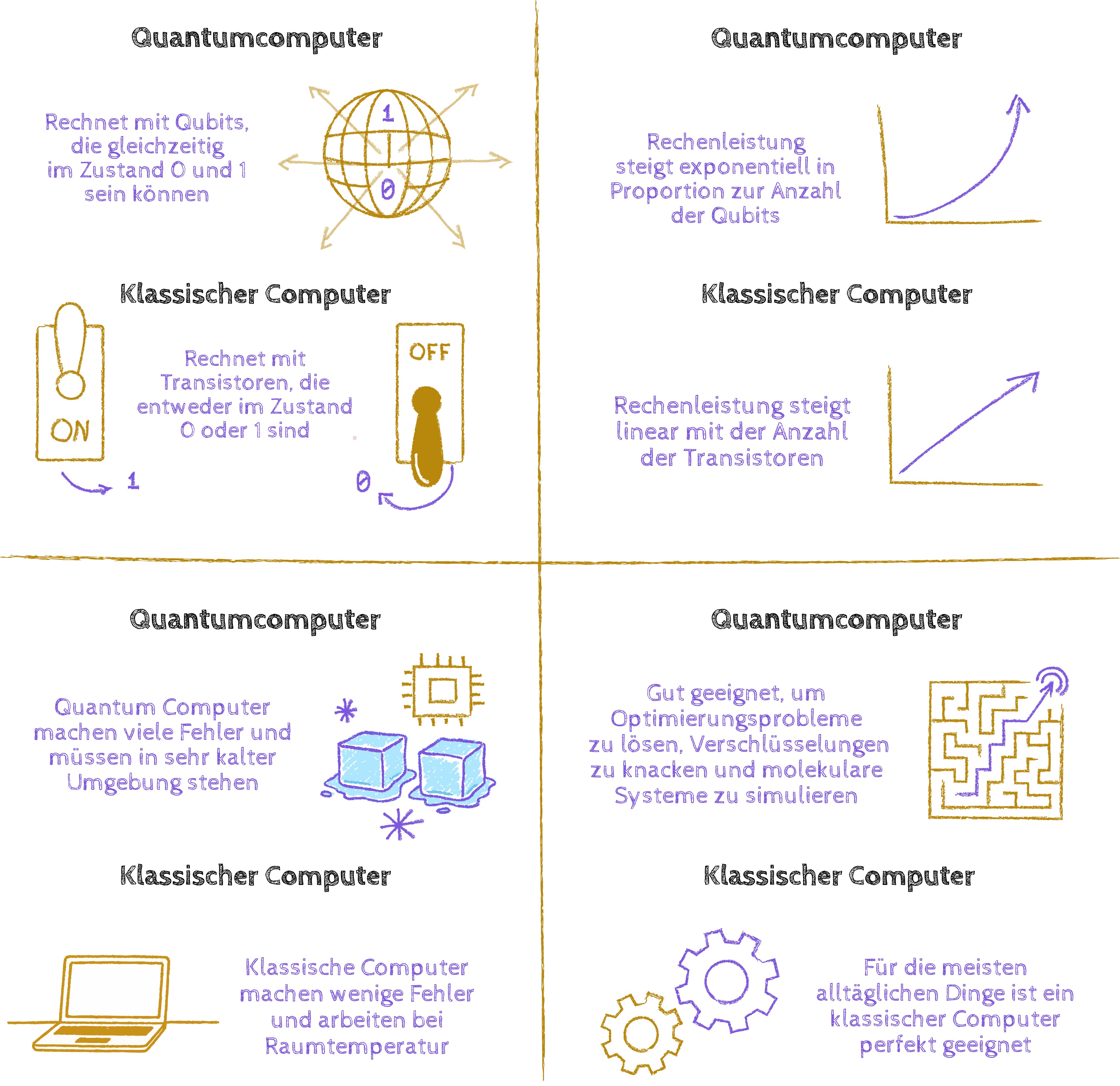
Was hat er damit konkret gemeint?
Markus Oppel: Es gibt eine Diskrepanz zwischen Quantenmechanik und klassischer Mechanik: Beim klassischen Computer ist alles null oder eins. Egal was es ist, ein Mobiltelefon, ein Supercomputer, es geht immer um Nullen und Einsen, die verknüpft sind oder hin und her geschaufelt werden. Aber die Quantenmechanik besteht eben nicht nur aus Nullen und Einsen, sondern es gibt die berühmten Zustände dazwischen, die überlagerten Zustände.
Feynman hatte die verrückte oder auch naheliegende Idee: Wenn wir Systeme beschreiben müssen, die null und eins und auch alles dazwischen sind, dann müssen wir auch ein mechanisches, technisches System verwenden, das genau das kann und nicht eben den normalen Computer, wo wir nur mit Nullen und Einsen rechnen. Die Quantencomputer heutzutage verwenden tatsächlich nicht Transistoren, Leiterbahnen und klassische Elektronik, die null oder eins beschreibt, sondern Quantensysteme verschiedenster Art, die eben genau diese Zustände repräsentieren, in denen verschiedene Situationen gleichzeitig gegeben sind.
“
Es gibt das Know-how, aber wir sind mit den Quantenrechnern derzeit auf dem technischen Niveau, auf dem die heutigen Computer in den 1930er-Jahren waren.
„
Wo stehen wir in Sachen Technologie bei Quantencomputern heute?
Markus Oppel: Bei Computern geben wir die Leistung in Bits an, bei Quantencomputern in Qubits. Bei realen Quantencomputern, wie es sie heute schon gibt, haben wir maximal ein paar Tausend Qubits. Aber wenn ein Quantenalgorithmus wirklich funktionieren und auch schneller als ein normaler Computer sein soll, braucht man Zehntausende, Hunderttausende Qubits. Das ist das Hauptproblem: Es gibt das Know-how, aber wir sind mit den Quantenrechnern derzeit auf dem technischen Niveau, auf dem die heutigen Computer in den 1930er-Jahren waren.
Also wissen wir, wie es theoretisch funktioniert, aber praktisch ist es noch nicht machbar?
Markus Oppel: Genau. Und die große Frage ist: Wann kommt es? Das wird natürlich schneller gehen als jetzt bei den bisherigen Computern. Ich gehe mal davon aus, optimistisch, dass die Studierenden, die heute im ersten Semester sind, in etwa 20 oder 30 Jahren tatsächlich ihre Simulationen auf Quantencomputern machen werden.
Einstweilen begnügen wir uns eben mit normalem High-Performance Computing. Sie begleiten Forschende bei ihren Simulationen auf Supercomputern weltweit. Was waren denn die spannendsten Projekte der letzten Jahre?
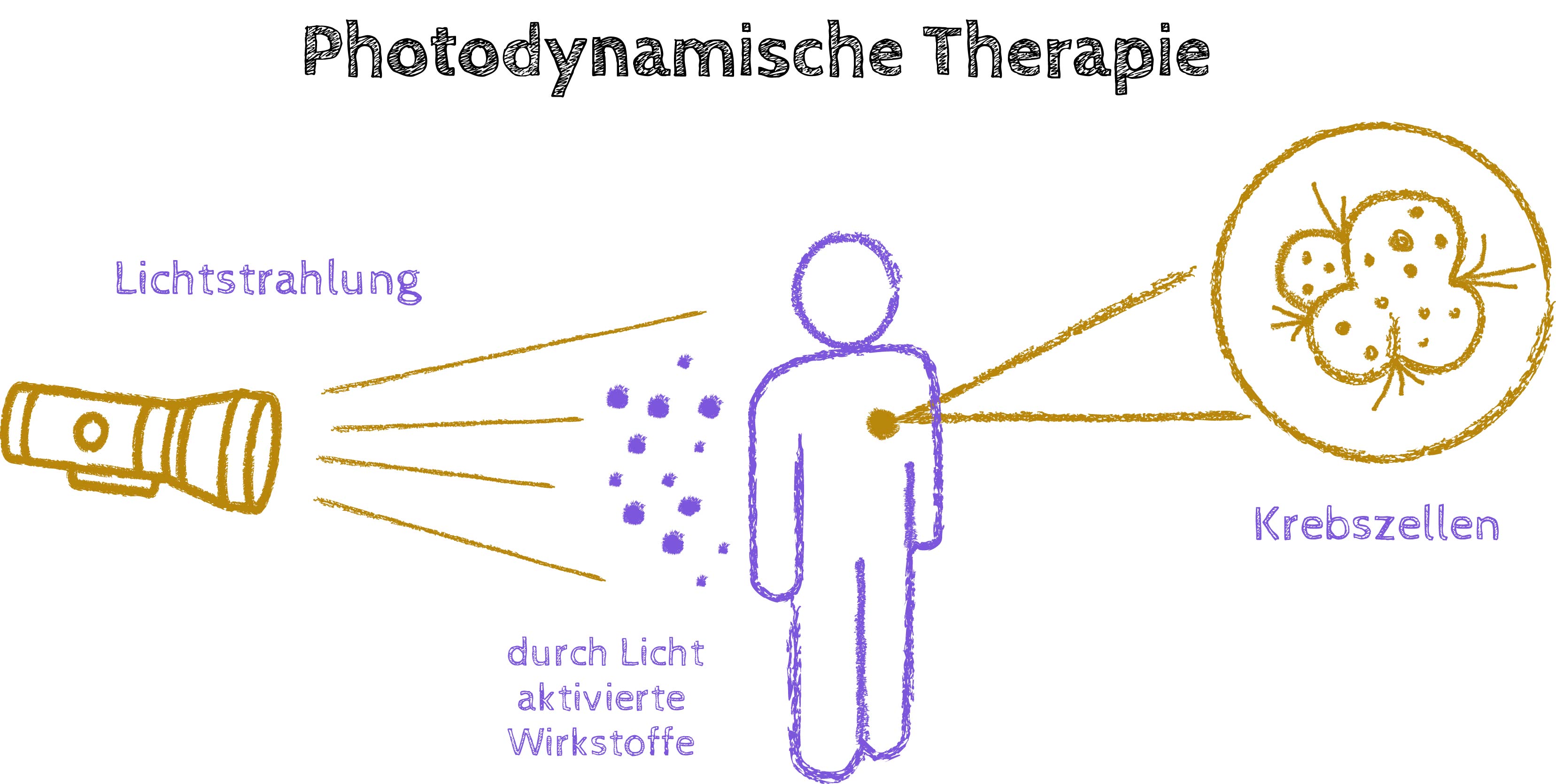
Markus Oppel: In unserer Arbeitsgruppe dreht sich alles um Licht, und zwar auf dem Level der Grundlagenforschung: Wir interessieren uns dafür, was ein Molekül macht, nachdem es durch Licht angeregt wurde. Vor einiger Zeit haben wir uns mit lichtaktivierten Platinkomplexen beschäftigt, die in der Krebstherapie zum Einsatz kommen könnten. Dazu haben wir am österreichischen Supercomputer VSC gearbeitet.
Wir haben zwei spannende Dinge verbunden: Es gibt seit den 1970er-Jahren eine Platinverbindung, die als Krebstherapie zugelassen ist. Parallel dazu existiert eine Therapiemethode, die sogenannte Photodynamische Therapie, bei der ein Medikament so lange inaktiv im Tumorgewebe bleibt, bis der Tumor mit Licht bestrahlt wird. Erst durch das Licht wird die therapeutische Wirkung aktiviert und die Tumorzelle angegriffen. Unsere Idee war: Wir nehmen das Konzept dieser Platinverbindungen, die prinzipiell als Antitumormittel funktionieren, versuchen da aber Verbindungen zu schaffen, die erst dann aktiv werden, wenn man sie mit Licht bestrahlt.
Das gab es vorher nicht?
Markus Oppel: Bei Platin meines Wissens nicht. Es wird viel geforscht, aber die zugelassenen Medikamente bei Photodynamischer Therapie kommen alle aus anderen Substanzklassen.
Was haben Sie bei diesem Projekt genau untersucht?
Markus Oppel: Bei unserem Projekt gehen wir von einem Platinatom aus, an dem verschiedene andere Moleküle angedockt sind. Durch das Licht werden diese hochreaktiven Fragmente abgespalten, welche die Tumorzelle zerstören können. Wir wollten verstehen, wie der Mechanismus der Abspaltung genau funktioniert und welche Art von Licht man dazu braucht.
“
Bei unserem Projekt gehen wir von einem Platinatom aus, an dem verschiedene andere Moleküle angedockt sind. Durch das Licht werden diese Fragmente abgespalten, die die Tumorzelle zerstören können.
„
Welche Rolle spielen Ihre Forschungen im Prozess der Medikamentenentwicklung?
Markus Oppel: Der gesamte Prozess des Drug-Designs dauert in der Regel mehr als zehn Jahre, und unsere Arbeit steht eher am Anfang. Aber noch vorher geht es ganz generell um das Verstehen der Krankheit: Man definiert zuerst, was überhaupt eine bestimmte Krankheit auslöst. Meistens findet man irgendwelche Proteine im Körper, die nicht richtig funktionieren. Dann ist der nächste Schritt zu fragen: Kann ich die Krankheit heilen oder eindämmen, indem ich zum Beispiel dieses oder jenes Protein oder Enzym blockiere? Und wie kann ich das machen? Es ist also ein Screening im wahrsten Sinne des Wortes, bei dem man alle möglichen denkbaren Verbindungen dahingehend untersucht, ob eine oder mehrere dieser Verbindungen mit diesem Enzym wechselwirken. Das wird heutzutage im ersten Schritt am Computer gemacht.
Der große Vorteil dabei ist, dass die Software tausende von verschiedenen Stoffen durchtesten kann und auch nach neuen Molekülen sucht, auf die wir selbst gar nicht gekommen sind. Am Ende dieser Simulation hat man aus 20.000 Molekülen vielleicht 100 gefiltert, die vielversprechend sind. Damit geht es dann ins Labor, wo alles getestet wird.
Aber das ist nur die erste Hälfte: Wenn Sie dann einen einzigen Stoff haben, der nach den Labortests übrigbleibt, müssen Sie schauen, ob Sie ihn produzieren können, und ob er überhaupt einem Patienten verabreicht werden kann, ohne dass der Schaden nimmt. Kurzum: Drug-Design ist ein langer Prozess, und wir stehen ganz am Anfang. Bei uns in der Arbeitsgruppe geht es immer darum: Wie interagiert ein Molekül mit anderen Substanzen, speziell mit Licht?
“
Jeder Chemiker weiß: Die meisten organischen Substanzen gehen relativ schnell kaputt, wenn Sie in der Sonne liegen. Es stellt sich also die Frage: Warum und wie können wir Menschen – aber auch Pflanzen und Tiere – teilweise sehr starke Sonneneinstrahlung überleben?
„
Wie erforschen Sie das konkret?
Markus Oppel: Wir haben entsprechende Simulationstechniken, auch unsere eigene Software, die wir in den vergangenen zehn Jahren entwickelt haben. So können wir zum Beispiel auch untersuchen, warum unsere Körperzellen eigentlich nicht absterben, wenn sie auf Sonnenlicht treffen. Denn jeder Chemiker weiß: Die meisten organischen Substanzen gehen relativ schnell kaputt, wenn Sie in der Sonne liegen. Es stellt sich also die Frage: Warum und wie können wir Menschen – aber auch Pflanzen und Tiere – teilweise sehr starke Sonneneinstrahlung überleben? Das hat natürlich verschiedene Gründe, und die untersuchen wir.
Wir haben zum Beispiel zwei Basen der DNA angesehen: Adenin und Guanin. In der Computersimulation konnten wir zeigen, was in Echtzeit mit diesen Basen passiert, wenn sie mit Sonnenlicht in Berührung kommen.
Was kam heraus?
Markus Oppel: Die beiden fangen die Energie des Lichts auf und sind in der Lage, diese Energie in Wärme umzuwandeln. Sie beginnen zu schwingen, geben so Wärme ab und bleiben selbst unbeschädigt.
Ist das eine neue Erkenntnis oder etwas, das vorher schon untersucht wurde?
Markus Oppel: Es gab schon statische Hinweise, wie das funktionieren könnte – aber wir konnten zum ersten Mal simulieren, was in Echtzeit wirklich passiert. Das ist eine unserer Stärken: Wir zeigen, was passiert, wenn das Molekül mit Licht wechselwirkt – und zwar mitsamt seiner Umgebung. Im Fall der Basen ist das meist eine wässrige Lösung, wie sie in menschlichem Gewebe eben vorkommt. Wir können also das Molekül mit seiner Umgebung simulieren und so das große Bild sehen, anstatt nur das isolierte Einzelteil. Das bringt natürlich viel mehr Klarheit über die verschiedensten Prozesse.
“
Es gab schon statische Hinweise, wie das funktionieren könnte – aber wir konnten zum ersten Mal simulieren, was in Echtzeit wirklich passiert.
„
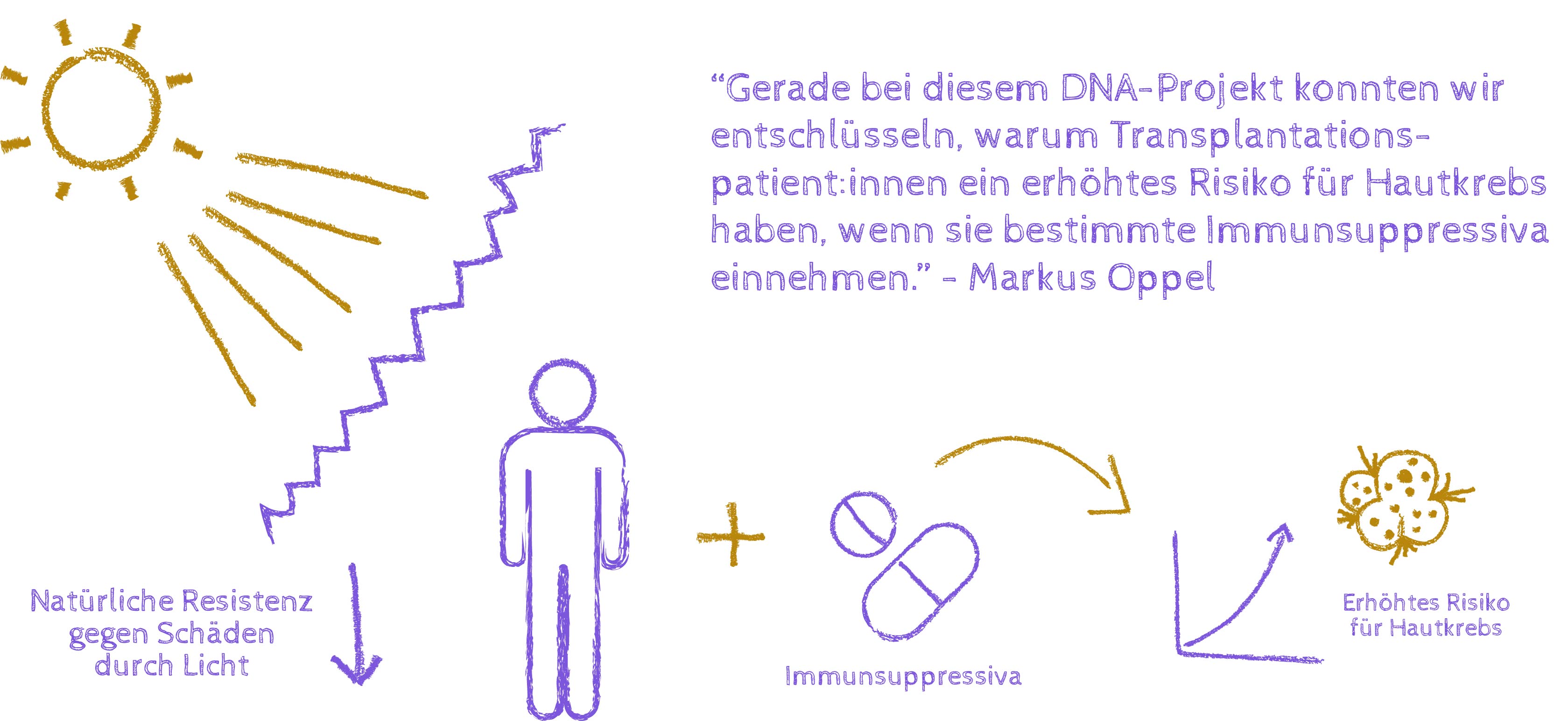
Gerade bei diesem DNA-Projekt konnten wir den Mechanismus hinter einem bekannten Phänomen entschlüsseln: Eines dieser Basenpaare ist das Guanin-Zytosin-Paar. Man kann im Guanin nun zum Beispiel ein Sauerstoffatom durch Schwefel ersetzen, was in der Praxis tatsächlich auch gemacht wird. Dabei bekommt man eine Substanzklasse, die unter anderem als Immunsuppressiva für Transplantationspatient:innen eingesetzt wird. Es ist bekannt, dass Patient:innen durch diese modifizierte Aminosäure ein erhöhtes Hautkrebsrisiko haben. Wir konnten zeigen, dass die Basen durch Schwefel weniger resistent gegen Sonnenlicht sind: Das Licht wird nicht einfach in Wärme umgewandelt, sondern die Energie bleibt gespeichert und schädigt die Zelle.
Schauen wir mal in die Zukunft: Gibt es einen wissenschaftlichen Durchbruch, bei dem Sie sagen würden: „Dafür hat sich die ganze Arbeit an den HPC-Systemen dieser Welt gelohnt?“
Markus Oppel: Dazu sind wir zu sehr down to earth, würde ich sagen. Naturwissenschaft ist heutzutage ein Multiplayerspiel. Wir arbeiten in Teams, und viele Teams arbeiten an gleichen Problemen. Es geht um viele kleine Puzzlesteine. Wenn Sie am Ende das große Bild haben, fertig gerahmt an der Wand, ist die Frage nicht: Welcher einzelne Mensch hat dieses Kunstwerk erschaffen? Denn es waren alle beteiligt.
Das heißt, Wissenschaftler:innen müssen maximal teamfähig sein?
Markus Oppel: Unbedingt. Ich sage das auch den Studierenden in den ersten Semestern: Arbeitet zusammen. Ich empfehle euch von Anfang an: Wenn ihr Aufgaben lösen müsst, bitte zusammenarbeiten. Auch auf die Gefahr hin, dass nur einer tut und die anderen abschreiben: Es ist wichtig, dass sich die Leute zusammensetzen und die Stärken jedes einzelnen für die Gruppe nutzen.
“
Es ist wichtig, dass sich die Leute zusammensetzen und die Stärken jedes Einzelnen für die Gruppe nutzen.
„
Zur Person
Dr. Markus Oppel ist Senior Scientist am Institut für Theoretische Chemie der Universität Wien und Experte für High-Performance Computing (HPC) und Quantencomputing in der Chemie. Zu seinem Arbeitsalltag gehört die Betreuung eines institutseigenen Supercomputing-Clusters, die Beratung von Wissenschaftler:innen zum optimalen Einsatz großer Rechenressourcen sowie die Begleitung von Forschungsprojekten auf europäischen Hochleistungsrechnern. Zusätzlich lehrt er unter anderem Mathematik für Chemiker und High-Performance Computing in Chemistry.
Oppel arbeitet an Themen wie der Simulation chemischer Prozesse, quantendynamischer Reaktionen und dem Einsatz von Quantencomputern für die Wirkstoff- und Materialforschung.
